
Dlaczego warto wykonać badanie genów BRCA1/2 na jak najwcześniejszym etapie choroby?
W NINIEJSZYM ARTYKULE PORUSZONO NASTĘPUJĄCE ZAGADNIENIA:
-
Dlaczego warto wykonać badanie genów BRCA1/2 na jak najwcześniejszym etapie choroby?
-
Jak wiedza o statusie mutacji BRCA1/2 wpływa na podjęcie decyzji terapeutycznej?
-
Jak wiedza o statusie mutacji BRCA1/2 wpływa na ocenę ryzyka choroby nowotworowej u rodziny?
Dlaczego warto wykonać badanie genów BRCA1/2 na jak najwcześniejszym etapie?
Rak prostaty jest drugą co do liczby zachorowań i piątą główną przyczyną1 zgonów z powodu nowotworów wśród mężczyzn. Szacuje się, że na świecie roczna liczba nowych zachorowań to 4 mln i 375 tys. zgonów2. W 2020 roku wykryto około 1,400 mln nowych przypadków3.
Na postępowanie w przypadku raka prostaty istotny wpływ wywarła identyfikacja genów BRCA1 i BRCA2, rosnąca dostępność badań genetycznych oraz rozwój terapii ukierunkowanych4,5.
Większość pacjentów z rakiem prostaty znajduje się we wczesnym stadium choroby, które często przebiega w sposób bezobjawowy, ale wraz z upływem czasu wielu pacjentów wykształca oporność na terapie hormonalne i przechodzi do stadium uogólnionego opornego na kastrację raka prostaty (mCRPC: Metastatic Castration- Resistant Prostate Cancer)6. Statystycznie u około 40% pacjentów z rakiem prostaty wystąpią przerzuty, a szacunkowy wskaźnik 5-letniego przeżycia w przypadku chorych z przerzutami utrzymuje się na poziomie 40-49%4,5,7. Dlatego priorytetem jest poprawa w zakresie badań przesiewowych, wykrywania choroby i stawianej diagnozy.
Rak prostaty z przerzutami jest biologicznie heterogenny, dochodzi do wielu uszkodzeń(mutacji) DNA8.
Szczególną rolę odgrywają mutacje w szlakach naprawy DNA. Mogą one prowadzić do niestabilności genomowej i stymulować wzrost guza9,10. Około ¼ pacjentów z uogólnionym opornym na kastrację rakiem prostaty (mCRPC) ma zmiany związane ze szlakami naprawy DNA, w szczególności w szlaku rekombinacji homologicznej (HRR – ang. homologous recombination repair), która jest kluczowym mechanizmem naprawczym11.
Białka BRCA1 i BRCA2 są obecnie najbardziej znanymi elementami szlaku rekombinacji homologicznej, przy czym mutacje w genach BRCA2 występują w raku prostaty częściej niż BRCA112,13. Wykazano, że wiele innych genów jest bezpośrednio lub pośrednio zaangażowanych w proces naprawy DNA w mechanizmie rekombinacji homologicznej14.
Pacjenci z rakiem prostaty i z mutacjami w genach BRCA1/2 mają zazwyczaj bardziej agresywny przebieg choroby oraz mogą osiągać mniejszą korzyść z zastosowania standardowych opcji leczenia13,15–18.
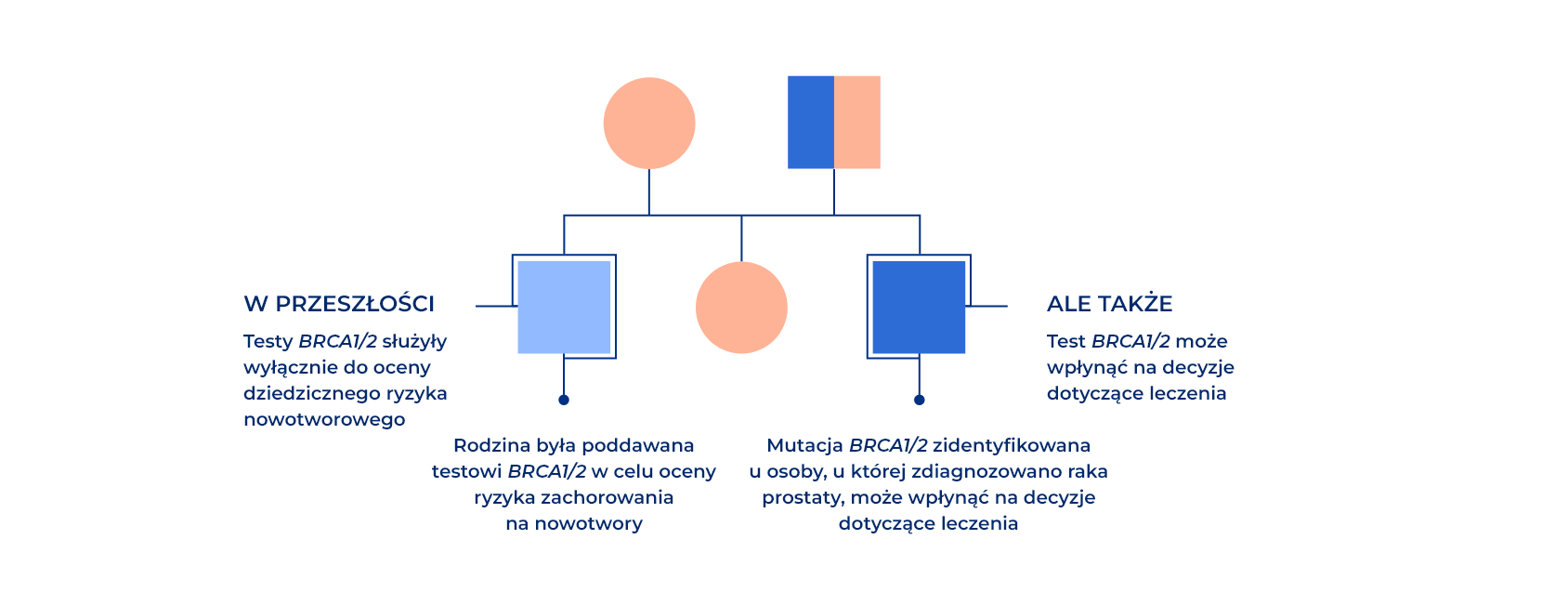
W przeszłości testy BRCA1/2 były wykorzystywane głównie do oceny ryzyka nawrotu choroby u danej osoby, ryzyka zachorowania na inne nowotwory związane z BRCA1/2 oraz prawdopodobieństwa przekazania mutacji krewnym19. Obecnie testy BRCA1/2 mogą być wykorzystywane do podejmowania decyzji dotyczących leczenia20,21.
Znaczenie wczesnego testowania BRCA1/2 jest dostrzegane przez wiodące towarzystwa naukowe zajmujące się rakiem prostaty. Na przykład Europejskie Stowarzyszenie Urologów (EAU) w wydaniu z 2020 roku zaleca, aby u pacjentów z uogólnionym opornym na kastrację rakiem prostaty (mCRPC) rozważyć badanie tkanki nowotworowej pobranej przy rozpoznaniu nowotworowym lub badanie z krwi, wykrywające wolnokrążące DNA nowotworowe – tzw. płynną biopsję (ctDNA – ang. circulating tumor DNA) lub badanie z tkanki pobranej z przerzutu22.
Badanie mutacji BRCA1/2 jest ważne, ponieważ może dostarczyć informacji na temat:
Monitorowania:14,15
-
Osoby z germinalną (dziedziczną) mutacją w genach BRCA1/2 charakteryzują się podwyższonym ryzykiem rozwoju niektórych nowotworów, takich jak rak jajnika, rak piersi, rak trzustki i rak prostaty23.
-
Identyfikacja osób z mutacją germinalną w genach BRCA1/2 może wpłynąć na zaplanowanie profilaktyki nowotworowej24,25.
Implikacji rodzinnych:
-
Pacjenci z mutacją germinalną BRCA1/2 mogą przekazać ją swojemu potomstwu lub mogą mieć rodzeństwo, które jest nosicielem mutacji germinalnej BRCA1/2. Dlatego tacy członkowie rodziny mogą odnieść korzyści z dokładnej oceny ryzyka zachorowania na raka oraz zindywidualizowanych badań przesiewowych/profilaktycznych12,26,27.
Implikacji prognostycznych:
-
U pacjentów z mutacją w genach BRCA1/2 istnieje większe prawdopodobieństwo wystąpienia przerzutów niż u pacjentów bez mutacji12,13,15.
Możliwości leczenia pacjenta:
-
Pacjenci z mutacją BRCA mogą mieć większe szanse na skorzystanie z niektórych metod leczenia o bardziej ukierunkowanym działaniu9,10.
Jak wiedza o statusie mutacji BRCA1/2 wpływa na podjęcie decyzji terapeutycznej?
Badania mutacji w genach BRCA 1/2 u pacjentów z rakiem prostaty są ważne, ponieważ mogą pomóc w doborze leczenia. Wytyczne zalecają testowanie pacjentów z rakiem prostaty w kierunku poszukiwania mutacji germinalnych i/lub somatycznych w genach BRCA1/2, aby pomóc w określeniu opcji leczenia22,24,29–32.
Jak wiedza o statusie mutacji BRCA1/2 wpływa na ocenę ryzyka rodzinnego?
Analiza dziedzicznych mutacji genów u pacjentów z zaawansowanym rakiem prostaty wykazała, że mutacje BRCA2 są często występującą mutacją dziedziczną w tej grupie (~5% pacjentów)33. Dziedziczne mutacje BRCA1 są również obserwowane w przypadku zaawansowanego raka prostaty, jednak w mniejszym stopniu niż mutacje BRCA2 (~1%)33. Obecność dziedzicznych mutacji BRCA1/2 zwiększa rodzinne ryzyko zachorowania na nowotwory i ma wpływ na rokowanie i decyzje dotyczące leczenia u osób, u których rozwinie się rak prostaty12,13,26–28.
Mimo iż około 30-40% nosicieli takich mutacji nie zgłasza w wywiadzie choroby nowotworowej w rodzinie, to uogólniony rak prostaty może być sygnałem dziedzicznej predyspozycji do zachorowania na raka34.
Wytyczne zalecają poradnictwo genetyczne dla pacjentów z ogólnionym opornym na kastrację rakiem prostaty (mCRPC), aby zidentyfikować ryzyko rodzinne22,24,29–32.
Referencje:
- Sung H et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
- Global Cancer Observatory. 27-Prostate-fact-sheet. Online: https://gco.iarc.fr/today/data/factsheets/cancers/27-Prostate-fact-sheet.pdf [dostęp:22.01.2024].
- Global Cancer Observatory. 900 World Fact Sheets. Online: https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf [dostęp: 25.01.2024]
- Sciarra A, Salciccia S. A novel therapeutic option for castration-resistant prostate cancer: after or before chemotherapy? Eur Urol. 2014;65(5):905-906.
- Beltran H et al. New therapies for castration-resistant prostate cancer: efficacy and safety. Eur Urol. 2011;60(2):279-290.
- Ng K et al. Metastatic Hormone-Sensitive Prostate Cancer (mHSPC): Advances and Treatment Strategies in the First-Line Setting. Oncol Ther. 2020;8(2):209-230.
- Cancer Research UK. Prostate Cancer Statistics. Online: https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/prostate-cancer [dostęp:22.01.2024].
- Robinson D et al. Integrative Clinical Genomics of Advanced Prostate Cancer. Cell. 2015;162(2):454.
- Ashworth A, Lord CJ. Synthetic lethal therapies for cancer: what’s next after PARP inhibitors? Nat Rev Clin Oncol. 2018;15(9):564-576.
- O’Connor MJ. Targeting the DNA Damage Response in Cancer. Mol Cell. 2015;60(4):547-560.
- de Bono JS et al. 847PD – Central, prospective detection of homologous recombination repair gene mutations (HRRm) in tumour tissue from >4000 men with metastatic castration-resistant prostate cancer (mCRPC) screened for the PROfound study. Ann Oncol. 2019;30:328-329.
- Messina C et al. BRCA Mutations in Prostate Cancer: Prognostic and Predictive Implications. J Oncol. 2020;2020:e4986365.
- Castro E et al. Effect of BRCA Mutations on Metastatic Relapse and Cause – specific Survival After Radical Treatment for Localised Prostate Cancer. Eur Urol. 2015;68(2):186-193.
- Wright WD et al. Homologous recombination and the repair of DNA double- strand breaks. J Biol Chem. 2018;293(27):10524-10535.
- Taylor RA et al. Germline BRCA2 mutations drive prostate cancers with distinct evolutionary trajectories. Nat Commun. 2017;8(1):13671.
- Na R et al. Germline Mutations in ATM and BRCA1/2 Distinguish Risk for Lethal and Indolent Prostate Cancer and are Associated with Early Age at Death. Eur Urol. 2017;71(5):740-747.
- Reimers MA et al. Clinical Outcomes in Cyclin-dependent Kinase 12 Mutant Advanced Prostate Cancer. Eur Urol. 2020;77(3):333-341.
- Antonarakis ES et al. CDK12-altered prostate cancer: Clinical features and therapeutic outcomes to standard systemic therapies, PARP inhibitors, and PD1 inhibitors. Ann Oncol. 2019;30:326-327.
- Annala M et al. Treatment Outcomes and Tumor Loss of Heterozygosity in Germline DNA Repair-deficient Prostate Cancer. Eur Urol. 2017;72(1):34-42.
- Hoogerbrugge N, Jongmans MC. Finding all BRCA pathogenic mutation carriers: best practice models. Eur J Hum Genet EJHG. 2016;24 Suppl 1:19-26.
- Pal T, Vadaparampil ST. Genetic Risk Assessments in Individuals at High Risk for Inherited Breast Cancer in the Breast Oncology Care Setting. Cancer Control. 2012;19(4):255-266.
- Cornford P et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer. Part II-2020 Update: Treatment of Relapsing and Metastatic Prostate Cancer. Eur Urol. 2021;79(2):263-282.
- BRCA Gene Mutations: Cancer Risk and Genetic Testing Fact Sheet – National Cancer Institute.. Online: https://www.cancer.gov/about-cancer/causes- prevention/genetics/brca-fact-sheet [dostęp:22.01.2024].
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Prostate Cancer V2.2021. National Comprehensive Cancer Network, Inc. All rights reserved. Online: https://nccn.org [dostęp:22.01.2024].
- EAU-ESUR-ESTRO-SIOG-Guidelines-on-Prostate-Cancer-large-text-V2. Online: https://www.europeanurology.com/article/S0302-2838(20)30769-7/fulltext [dostęp:22.01.2024].
- Cheng HH et al. Germline and Somatic Mutations in Prostate Cancer for the Clinician. J Natl Compr Cancer Netw JNCCN. 2019;17(5):515-521.
- National Cancer Institute. Definition of germline mutation – NCI Dictionary of Cancer Terms. Online: https://www.cancer.gov/publications/dictionaries/cancer-terms/def/germline-mutation [dostęp:22.01.2024].
- Mateo J et al. Genomics of lethal prostate cancer at diagnosis and castration resistance. J Clin Invest. 130(4):1743-1751.
- American Urological Association. Advanced Prostate Cancer: AUA/ASTRO/SUO Guideline. Online: https://www.auanet.org/guidelines/guidelines/advanced-prostate-cancer [dostęp:22.01.2024].
- Parker C et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2020;31(9):1119-1134.
- Giri VN et al. Implementation of Germline Testing for Prostate Cancer: Philadelphia Prostate Cancer Consensus Conference 2019. J Clin Oncol Off J Am Soc Clin Oncol. 2020;38(24):2798-2811.
- Gillessen S et al. Management of Patients with Advanced Prostate Cancer: Report of the Advanced Prostate Cancer Consensus Conference 2019. Eur Urol. 2020;77(4):508-547.
- Pritchard CC et al. Inherited DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med. 2016;375(5):443-453.
- Kiciński M et al. An Epidemiological Reappraisal of the Familial Aggregation of Prostate Cancer: A Meta-Analysis. PLoS ONE. 2011;6(10).
Dowiedz
się więcej
Dowiedz się czym dokładnie jest BRCA1/2 i co zrobić, aby
zadbać o siebie i bliskich.