
Jak wykonać badanie genów BRCA1/2?
W NINIEJSZYM ARTYKULE PORUSZONO NASTĘPUJĄCE ZAGADNIENIA:
-
Mutacje germinalne a somatyczne
-
Jak wiedza o statusie mutacji BRCA1/2 wpływa na ocenę ryzyka rodzinnego?
Jak przeprowadzić badanie BRCA1/2
Mutacje w genach BRCA1/2 mogą być germinalne lub somatyczne1,2.
-
Mutacje germinalne występują w komórkach rozrodczych (plemniku lub komórce jajowej) i są przekazywane bezpośrednio przez rodzica, dlatego ten rodzaj mutacji może być dziedziczony, a tym samym może informować o ryzyku rodzinnym. Mutacje germinalne są obecne w DNA każdej komórki ciała3. Chociaż nie u każdej osoby z mutacją germinalną w genie BRCA wystąpi w rodzinie rak prostaty, to istnieje ryzyko, że mutacja ta może zostać przekazana potomstwu nosiciela1.
-
Mutacje somatyczne to spontaniczne zmiany genetyczne. Ten rodzaj mutacji może rozwinąć się w każdej komórce ciała, z wyjątkiem komórek germinalnych (rozrodczych). W związku z tym mutacji somatycznych nie można odziedziczyć ani przekazać potomstwu. Aby ją wykryć, badaniu należy poddać tkankę nowotworową4.
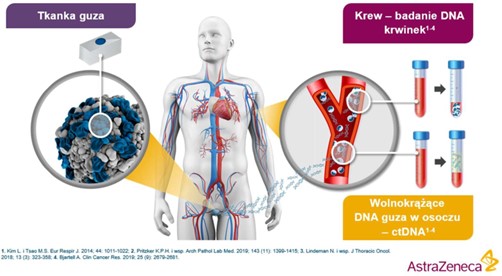
Badanie z tkanki może wykryć zarówno mutacje BRCA1/2 występujące tylko w guzie (mutacje somatyczne), jak i mutacje germinalne, czyli takie, które są obecne we wszystkich komórkach organizmu (mutacje dziedziczne). Nie jest ono jednak w stanie jednoznacznie określić, czy dana mutacja ma charakter somatyczny, czy dziedziczny. Dlatego w przypadku identyfikacji mutacji w genach BRCA1/2 zaleca się wykonanie dodatkowego badania z krwi w celu ustalenia, czy mutacja jest dziedziczna5. Inną metodą identyfikacji mutacji w genach BRCA1/2 jest badanie wolnokrążącego DNA nowotworowego (ctDNA) w krwi, które polega na analizie DNA pochodzącego z komórek nowotworowych — można je wykorzystać do wykrycia mutacji zarówno somatycznych, jak i germinalnych6.
Częstość występowania mutacji BRCA1 i BRCA2 przypadku pacjentów z rakiem prostaty*8
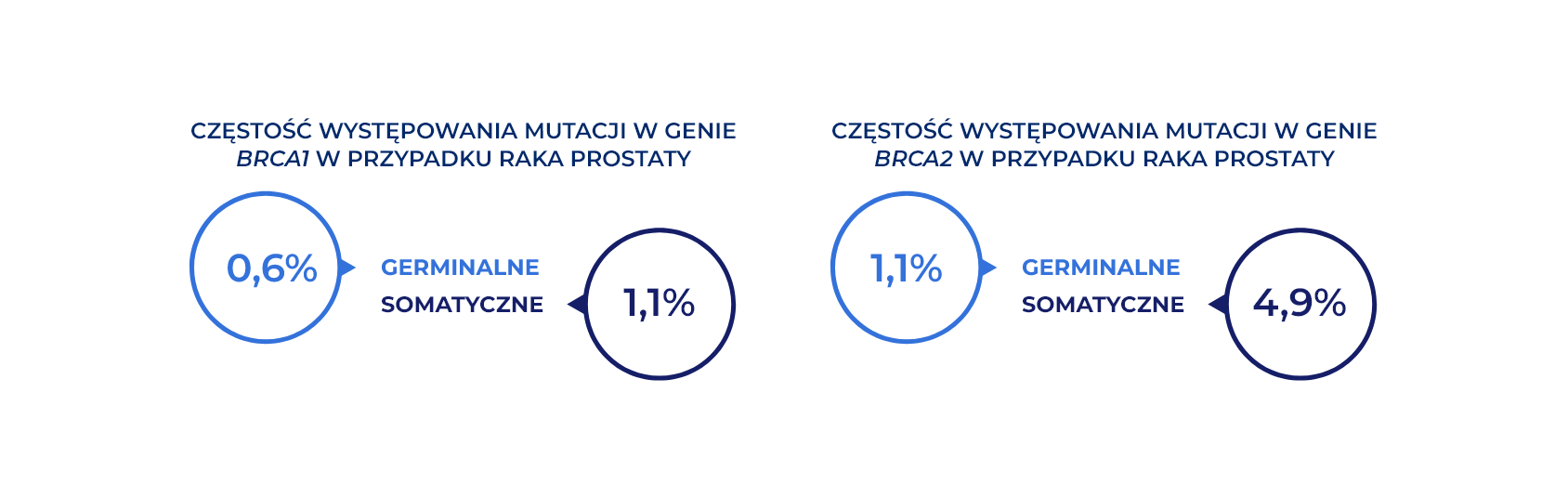
*Częstość występowania mutacji germinalnych i somatycznych w genach BRCA1 i BRCA2 w raku prostaty w ujęciu przeglądowym. gBRCA1 na podstawie wyników 7 badań, w których udział wzięło ogółem 4784 pacjentów; gBRCA2 na podstawie wyników 8 badań, w których udział wzięło ogółem 5894 pacjentów; sBRCA1 na podstawie wyników 5 badań, w których udział wzięło 2487 pacjentów; sBRCA2 na podstawie wyników 9 badań, w których udział wzięło 3266 pacjentów8.
Mutacja BRCA może być albo germinalna, albo somatyczna1,2.

Badanie tkanki nowotworowej (guza)
Badania molekularne materiału z guza są wykorzystane do identyfikacji zmian genetycznych w komórkach nowotworowych, które mogą być przyczyną rozwoju nowotworu9. Tkanki utrwalone w formalinie zatopione w parafinie (FFPE), potocznie nazywane bloczkami, są rutynowo przygotowywane w jednostkach diagnostyki patomorfologicznej w większości szpitali i są powszechnie wykorzystywane do wielu różnych badań10-13. Dzięki postępowi w dziedzinie sekwencjonowania następnej generacji (NGS), tkanki FFPE mogą być obecnie wykorzystywane w badaniach molekularnych14.
Badanie materiału z guza pozwala wykryć zarówno mutacje somatyczne, jak i germinalne, ale dopiero kolejne badanie z wykorzystaniem krwi pacjenta może potwierdzić, czy zidentyfikowane mutacje są dziedziczne2,11.
Użyteczność badań z tkanki z guza rośnie wraz z rozwojem coraz większej liczby terapii celowanych6-9.
Do wykrycia somatycznych mutacji w genach BRCA1/2 wymagane jest badanie materiału z guza15,16.
W porównaniu z badaniem krwi, badanie materiału z guza może zwiększyć odsetek mężczyzn z rakiem prostaty, u których identyfikuje się mutacje w genach BRCA1/28.
Badania mutacji germinalnych z krwi
Od pacjenta pobiera się próbkę krwi i wysyła do wewnętrznego lub zewnętrznego laboratorium w celu wyizolowania DNA. DNA jest przetwarzane i badane w celu określenia obecności mutacji germinalnej BRCA1/29.
Badanie tylko mutacji germinalnych (dziedzicznych) jest łatwe do wykonania, wykorzystuje bowiem materiał pobrany z krwi, śliny lub wymazu z policzka i może posłużyć do oceny ryzyka rodzinnego. Należy jednak pamiętać, że ten rodzaj testu nie identyfikuje mutacji somatycznych w genach BRCA1/25,17.
Testy wolnokrążącego DNA nowotworowego (ctDNA)
Wolnokrążące DNA nowotworowe (ctDNA) może być wykorzystywane do identyfikacji zarówno zmian somatycznych, jak i germinalnych w DNA nowotworowym6.
Wolnokrążące DNA nowotworowe ma wysokie stężenie we krwi u około 60-75% pacjentów z uogólnionym opornym na kastrację rakiem prostaty (mCRPC) i dlatego może być wykorzystywane do wykrywania mutacji BRCA1/2 6,18.
Badanie ctDNA jest pomocną alternatywą identyfikacji mutacji w genach BRCA1/2, w przypadku braku dostępności materiału tkankowego lub dostępu do materiału tkankowego słabej jakości, niepozwalającej na przeprowadzenie badań molekularnych19.
Wolnokrążące DNA (cfDNA) i wolnokrążące DNA nowotworowe (ctDNA) są uwalniane przez umierające komórki, w tym komórki guza prostaty. cfDNA i ctDNA przechodzą do krwiobiegu i mogą być wykrywane w próbkach osocza i wykorzystywane do identyfikacji mutacji.
Badanie NGS (Next-Generation Sequencing – Sekwencjonowanie Nowej Generacji)
Badania genomowe w raku prostaty rozwinęły się na przestrzeni lat. Początkowo sekwencjonowano pojedyncze geny, co było pracochłonne i kosztowne15. Wraz z postępem technologii NGS wprowadzono panele wielogenowe, które pozwalają na szerszą ocenę genetyczną, szybszy proces badania, większą przepustowość, a przy tym optymalizują koszty diagnostyki16.
Istotne klinicznie sekwencje genów zostały włączone do paneli genów badanych metodą NGS, zapewniając skuteczne narzędzia diagnostyczne do potencjalnej personalizacji terapii nowotworowych. Panele genów mogą oceniać wiele genów jednocześnie pod kątem specyficznych mutacji związanych z konkretnym nowotworem16.
Istnieje kilka metod badania mutacji w raku prostaty5.
-
Panel z ograniczoną liczbą genów: BRCA1 i BRCA2 – analiza sekwencji kodujących genów BRCA1 i BRCA2.16
-
Panel wielogenowy: Wiele mutacji – bada status mutacji wielu genów za pomocą tylko jednej próbki i obejmuje BRCA1 i BRCA2, a także inne geny związane z rakiem prostaty, które również biorą udział w naprawie DNA w procesie rekombinacji homologicznej (HRR)9,16.
Referencje:
- Messina C et al. BRCA Mutations in Prostate Cancer: Prognostic and Predictive Implications. J Oncol. 2020;2020:e4986365.
- Griffiths AJ et al. Somatic versus germinal mutation. Introd Genet Anal 8th Ed. 2021. Online: http://lgb.rc.unesp.br/biomol/literatura/Griffiths_8th.pdf [dostęp: 29.01.2024]
- National Cancer Institute. Definition of germline mutation – NCI Dictionary of Cancer Terms. 2011. Online: https://www.cancer.gov/publications/dictionaries/cancer-terms/def/germline-mutation [dostęp:22.01.2024].
- National Cancer Institute. Definition of somatic mutation – NCI Dictionary of Cancer Terms. 2011. Online: https://www.cancer.gov/publications/dictionaries/cancer-terms/def/somatic-mutation [dostęp:22.01.2024].
- Cheng HH et al. Germline and Somatic Mutations in Prostate Cancer for the Clinician. J Natl Compr Cancer Netw JNCCN. 2019;17(5):515-521.
- Wyatt AW et al. Concordance of Circulating Tumor DNA and Matched Metastatic Tissue Biopsy in Prostate Cancer. J Natl Cancer Inst. 2017;109(12).
- Pritchard CC et al. Inherited DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med. 2016;375(5):443-453.
- Lang SH et al. A systematic review of the prevalence of DNA damage response gene mutations in prostate cancer. Int J Oncol. 2019;55(3):597-616.
- Normanno N et al. Molecular diagnostics and personalized medicine in oncology: challenges and opportunities. J Cell Biochem. 2013;114(3):514-524.
- Parker C et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2020;31(9):1119-1134.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Prostate Cancer V2.2021. National Comprehensive Cancer Network, Inc. All rights reserved. Online: https://nccn.org [ddostęp:22.01.2024].
- Mateo J et al. Olaparib in patients with metastatic castration-resistant prostate cancer with DNA repair gene aberrations (TOPARP-B): a multicentre, open- label, randomised, phase 2 trial. Lancet Oncol. 2020;21(1):162-174.
- Kato M et al. A computational tool to detect DNA alterations tailored to formalin-fixed paraffin-embedded samples in cancer clinical sequencing. Genome Med. 2018;10(1):44.
- McDonough SJ et al. Use of FFPE-derived DNA in next generation sequencing: DNA extraction methods. PLOS ONE. 2019;14(4):e0211400.
- Kamps R et al. Next-Generation Sequencing in Oncology: Genetic Diagnosis, Risk Prediction and Cancer Classification. Int J Mol Sci. 2017;18(2).
- Lynce F, Isaacs C. How Far Do We Go With Genetic Evaluation? Gene, Panel, and Tumor Testing. Am Soc Clin Oncol Educ Book Am Soc Clin Oncol Annu Meet. 2016;35:e72-78.
- Schweizer MT et al. Clinical determinants for successful circulating tumor DNA analysis in prostate cancer. The Prostate. 2019;79(7):701-708.
- Maurice-Dror C et al. Circulating tumor DNA fraction (ctDNA%) to independently predict for clinical outcomes in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol. 2021;39(15_suppl):5049- 5049.
- González-Billalabeitia E et al. Circulating tumor DNA in advanced prostate cancer: transitioning from discovery to a clinically implemented test. Prostate Cance Prostatic Dis. 2019;22(2):195-205.
Dowiedz
się więcej
Dowiedz się czym dokładnie jest BRCA1/2 i co zrobić, aby
zadbać o siebie i bliskich.